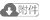2. 中国地质大学(武汉)工程学院, 武汉 430074;
3. 密苏里科技大学罗拉分校, 密苏里州 罗拉 65401
2. Faculty of Engineering, China University of Geosciences, Wuhan 430074, China;
3. Missouri University of Science and Technology at Rolla, Rolla 65401, Missouri, U.S.A
静安堡油田静35区块位于辽宁省沈阳市于洪区马三家子乡,构造上位于大民屯凹陷边台[1]。该区块具有浅水湖盆扇三角洲沉积特征,主要含油层位为沙三段四砂组,储层岩性以中粗粒砂岩为主,胶结物主要为泥质,平均孔隙度为14.7%,平均渗透率为259.7 mD。地面原油凝固点为45~60 ℃,含蜡质量分数为25.0%~56.7%[2-3]。1995年10月该区块上报Ⅰ类探明含油面积3.1 km2、地质储量781万t,截至2012年6月,累积产油36.37万t,地质储量采出程度仅为4.3%。
该区块开发难点在于:① 油藏埋藏浅,地温低,原油凝固点高且与地温接近,近井地带易形成蜡堵;② 岩性对油气分布控制作用明显,透镜状油藏类型比例高且天然能量不足,由于地层能量下降和油层蜡堵,区块产量下降很快。该区块历史上曾采用过热采技术如蒸汽吞吐、热水驱等,虽然在短时间内解决了蜡堵问题,增强了原油的流动性,但是作用时间短、能耗大、投入产出比低,开发效果不明显[2, 4-5],即便采用化学复合驱油,也未能解决高凝油蜡堵的问题,并造成油层结垢和设备腐蚀[6-7]。因此,急需找到一种高效率、低成本的石油开采技术来解决该区块目前存在的问题。
微生物采油技术(MEOR)利用微生物在油藏中的有益活动来提高原油的采收率。据文献[8]报道,自1926年美国人Beckman首先提出MEOR的设想以来,该技术在国外经历了近半个多世纪的发展。1986年美国国家能源研究所将微生物采油技术应用在俄克拉荷马州的Delawere-Childers油田并开展矿场先导试验,最终可使原油产量提高20%[9-10]。我国的MEOR研究始于20世纪60年代[11],到20世纪90年代该项技术开始以较大规模应用于大庆、吉林、大港、胜利等油田的矿场试验,其中吉林油田从1993年开始微生物吞吐采油,3年共实施86口井,见效率达70%,平均单井增油103 t,投入产出比为1: 4;辽河油田曙光采油厂在杜4块稠油井进行微生物吞吐现场试验,14口井中有10口见效,平均单井增油110.8 t[12-15]。尽管如此,针对高凝油的微生物采油研究和矿场试验,在国内外却仍不多见。
本次研究从微生物对原油蜡质降解、产表面活性剂和产大分子乳化剂三方面能力入手,开展高凝油微生物提高采收率应用研究和现场试验,通过分析原油四组分及饱和烃组分变化评价菌种对原油的降解能力,通过分析发酵液表面张力变化和乳化指数评价菌种产表面活性剂及乳化原油的能力,再将菌种进行互配以实现优势互补,优化并评价菌种对高凝油的降凝、降黏效果及其提高采收率的能力,以期得到一种协同性好且高效的微生物采油菌剂,并使用该菌剂来解决静35区块开发中存在的近井地带蜡堵问题,改善原油在地下的流动性,进而提高该区块原油产量。
1 实验材料与方法研究所使用微生物菌种均筛选自辽河油田高凝油油藏区块,属辽河油田高凝油油藏内源微生物。研究中首次将降解类、产表面活性剂类、产乳化剂类3种不同类型的菌种通过互配后制成高凝油微生物采油菌剂作用于高凝油,并通过室内物理模拟驱油实验及现场试验验证菌剂应用于高凝油采油的效果。
1.1 实验材料 1.1.1 菌株从辽河油田沈阳采油厂生产井采出液及周边油污土壤中分离、筛选、驯化得到3株微生物采油功能菌种:JD173,JD174,JDC18。经16 S-rDNA分子生物学方法及生理生化特性分析,菌种JD173,JD174,JDC18分别鉴定为嗜热脂肪地芽孢杆菌(Geobacillus stearothermophilus)、嗜热脱氮地芽孢杆菌(Geobacillus thermodenitrificans)和铜绿假单胞菌(Pseudomonas aeruginosa)。嗜热脂肪地芽孢杆菌,兼性厌氧芽孢杆菌,革兰氏染色呈阳性,最高生长温度为77 ℃,最适宜生长温度为56~65 ℃,菌体大小为7.0 μm×0.8 μm;嗜热脱氮地芽孢杆菌,兼性厌氧芽孢杆菌,革兰氏染色呈阳性,最高生长温度为80 ℃,最适宜生长温度为56~65 ℃,菌体大小为0.7 μm×5.0 μm;铜绿假单胞菌,革兰氏染色呈阴性,最适宜生长温度为30~40 ℃,菌体大小为(0.5~1.0)μm×(1.5~5.0)μm。
1.1.2 培养基培养基一为辽河油田沈阳采油厂采出水。按质量百分比计,各组分为:糖蜜0.5%,NaNO3 1%,K2 HPO4 0.3%,CaCl2 0.012%,MgSO4 0.024%,FeSO4 0.012%,Na2MoO4 0.008%及酵母粉0.05%。pH值为7.0~7.2。
培养基二为辽河油田沈阳采油厂采出水。按质量百分比计,各组分为:NaCl 0.3%,(NH4)2 SO4 0.15%,MgSO4 0.02%,NaNO3 0.3%,KH2 PO4 0.01%,K2 HPO4 0.05%,FeSO4 0.001%,酵母粉0.05%及蔗糖0.1%。pH值为7.0~7.2。
1.1.3 仪器与原油实验仪器包括恒温箱、美国ISCO高精度柱塞泵、真空泵、玻璃转子流量计、高压活塞式中间容器、压力表、自制油水分离计量装置、超净台、恒温摇床、BROOKFIELD DV-Ⅱ型黏度计、HP-6890 GC气相色谱仪、美国BECKMAN高速冷冻离心机等,原油使用辽河油田沈阳采油厂静35区块油井脱气高凝油。
1.2 实验方法 1.2.1 微生物单独作用原油将采用辽河油田沈阳采油厂采出水配置的培养液分装到三角瓶中灭菌,分别接入活化的嗜热脂肪地芽孢杆菌、嗜热脱氮地芽孢杆菌、铜绿假单胞菌,并保留一空白样,放入摇床(摇床转速为120 r/min),培养10 d。其中铜绿假单胞菌使用培养基一,培养温度为37 ℃,加入体积分数为1%的原油,培养4 d后,取部分发酵液分析其中生物表面活性剂类型及含量[16-18],表面活性剂含量检测采用蒽酮法[16]。嗜热脂肪地芽孢杆菌和嗜热脱氮地芽孢杆菌使用培养基二,培养温度为55 ℃,直接培养10 d,之后培养液在摇床转速为12 000 r/min、温度为4 ℃条件下离心20 min,进行油水分离,取上层油样保存,经加热脱水后进行原组分分析,同时取嗜热脂肪地芽孢杆菌、嗜热脱氮地芽孢杆菌培养液下层发酵液进行乳化指数分析。
使用HP-6890 GC气相色谱仪分别对经原油和微生物作用后的原油样品进行饱和烃气相色谱分析,用归一化方法求得各组分的质量分数,分析原油中饱和烃组分的变化。色谱分析条件为:柱长30 m,内径0.22 mm,柱温50~310 ℃;气化温度310 ℃;检测温度320 ℃;氢火焰离子化检测器载气为氮气,燃气为氢气(流速30 mL/min)和空气(流速300 mL/min)。
乳化指数测定方法:取2个刻度试管,分别加入柴油和原油,各3 mL,每个试管中再加入7 mL发酵液,剧烈振荡1 min,室温静置24 h后测量,以乳化层的高度除以有机相的总高度,再乘以100%,得到E24值,若该值大于50%,则认为乳化是稳定的。
1.2.2 复合微生物作用原油将铜绿假单胞菌接入培养基一,嗜热脂肪地芽孢杆菌和嗜热脱氮地芽孢杆菌接入培养基二,在摇床转速为180 r/min条件下震荡培养24 h,作为种子液。按体积分数为2%的接种量,及铜绿假单胞菌、嗜热脂肪地芽孢杆菌、嗜热脱氮地芽孢杆菌按0.5: 3.5: 6.0的接种比例,接入培养基二,同时加入体积分数为2%的原油,在摇床转速为120 r/min、温度为55 ℃条件下培养10 d,之后培养液在摇床转速为12 000 r/min、温度为4 ℃条件下离心20 min,进行油水分离,取上层油样保存,经加热脱水后进行组分分析,测定原油黏度及凝固点变化。使用BROOKFIELD DV-Ⅱ型黏度计测量原油的黏度,使用玻璃套管法测量凝固点。
1.2.3 物理模拟驱油评价实验利用石英砂制成渗透率分别为50 mD及200 mD的填砂管物理模型,将其抽真空4 h后饱和地层水,之后计量模型孔隙体积并计算出孔隙度,通过高凝油驱水建立束缚水,计算束缚水饱和度,使用油藏注入水驱油至极限含水率98%停止水驱,计算采收率,再注入复合微生物驱油菌剂,在温度为55 ℃条件下静止培养7 d,后续水驱至含水率98%时结束实验,计算驱油效率。微生物驱油菌剂体系为:铜绿假单胞菌、嗜热脂肪地芽孢杆菌、嗜热脱氮地芽孢杆菌发酵液按0.5: 3.5: 6.0的比例混合后,再使用油藏采出水稀释至体积分数为5%。
2 实验菌种采油性能研究 2.1 菌种单独作用前后原油四组分变化研究表明,嗜热脂肪地芽孢杆菌、嗜热脱氮地芽孢杆菌、铜绿假单孢菌对原油均具有较好的降解效果[11-12],可在中温油藏中将原油中的大分子长链烃组分降解为短链烃组分,进而可以降低原油的凝固点。本次研究将分离所得的3种菌种分别作用于辽河高凝油,并将作用后的原油收集再经脱水处理后测定其四组分相对含量变化(表 1)。嗜热脂肪地芽孢杆菌对沥青质和芳烃具有较明显的降解效果,降解率分别为30%和23%;嗜热脱氮地芽孢杆菌对沥青质降解效果显著,降解率达42.3%,同时对芳烃也具有一定的降解效果;铜绿假单胞菌对非烃和芳烃的降解效果显著,降解率分别为38.8%和35.8%。降解后饱和烃组分增加说明沥清质和芳烃的侧链被微生物优先降解了。
|
|
下载CSV 表 1 单一菌种降解原油前后四组分变化 Table 1 Changes of four components of crude oil before and after single strain degradation |
使用气相色谱法对经菌种作用后的原油进行气相色谱组检测和分析。分析结果显示:经菌种作用后,原油长碳链饱和烃含量降低,短碳链饱和烃含量增高。3种菌对原油中的长碳链饱和烷烃都具有生物降解作用(图 1、表 2),w(nC21-)/w(nC22+)值和w(nC21+nC22)/w(nC28+nC29)值增大表明原油长碳链组分相对减少,短碳链组分相对增加,w(Pr)/w(nC17)值和w(Ph)/w(nC18)值经微生物作用明显增大,表明地芽孢杆菌和假单孢菌作用于原油主要是降解长碳链饱和烃,微生物在降解长碳链饱和烃的同时生成短碳链饱和烃,这与文献研究结果相一致[19-22]。
|
下载eps/tif图 图 1 原油样品生物降解前后饱和烃气相色谱图 Fig. 1 Saturated hydrocarbon GC spectrum of oil sample before biodegradation |
|
|
下载CSV 表 2 单一菌种作用原油前后饱和烃气相色谱分析结果 Table 2 Saturated hydrocarbon GC results before and after single strain degradation |
测定菌种培养前后发酵液表面张力发现,培养后铜绿假单胞菌发酵液表面张力下降明显,培养前表面张力为72.21 mN/m,培养后降低为26.81 mN/m,降低了62.8%,说明该类菌种产生了生物表面活性剂。对发酵液中的表面活性剂进行定性鉴定和定量测定[14-16]:铜绿假单胞菌产生的生物表面活性剂为鼠李糖脂,质量浓度为10.8 mg/L的生物表面活性剂可以降低油水界面张力并形成油包水,降低原油黏度,同时也有利于微生物分散在原油中,增加其与原油的接触面积,促进微生物对原油的降解[23]。
2.4 发酵液乳化性能分析嗜热脂肪地芽孢杆菌和嗜热脱氮地芽孢杆菌菌种都可以很好地乳化分散原油。在加入原油的嗜热脂肪地芽孢杆菌和嗜热脱氮地芽孢杆菌发酵液中,原油呈墨汁状分散于水中且稳定性好,进一步检测2种菌种发酵液表面张力分别为60.41 mN/m和63.22 mN/m,与培养前发酵液表面张力72.21 mN/m相比变化不明显,说明这些细菌产生的代谢产物可能为一类大分子生物乳化剂。进一步测定发酵液的乳化指数如表 3所列,JD173菌株与JD174菌株发酵液乳化指数分别为70.6%和82.3%。
|
|
下载CSV 表 3 菌株JD173与JD174发酵液乳化指数 Table 3 Emulsion index of strain JD174 and strain JD173 cultures |
将嗜热脂肪地芽孢杆菌、嗜热脱氮地芽孢杆菌及铜绿假单胞菌配比组成微生物采油复合菌剂共同作用于高凝油,评价复合菌采油性能。
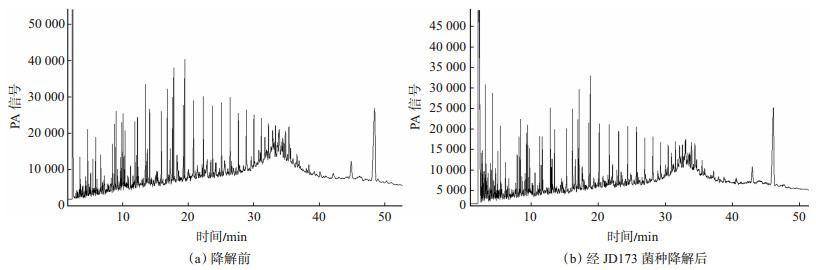
3.1 原油物化指标对经复合菌剂作用后的原油进行脱水处理,并测定其黏度、沥青质含量变化,结果表明黏度和沥青质质量分数分别下降了63.86%和31.35%。对复合菌剂作用前后原油流变性进行测定,所用仪器为BROOK FIELD-DV-Ⅲ UTRA流变仪,测试温度为55 ℃,剪切速率为0.5~25.0 s-1,转子号18。经测定在微生物作用后原油流变性得到了很好的改善。
微生物作用前原油的流动性能和黏度随着剪切速率增大而显著降低,而经供试菌株作用后原油黏度变化曲线趋于直线,黏度随着剪切速率增大而缓慢降低(图 2)。这一结果表明供试菌株作用前原始油样的表观黏度表现为假塑性流体特性,而经供试菌株作用后使原油的流体性质发生了改变,原油的表观黏度趋于牛顿流体特性。
|
下载eps/tif图 图 2 微生物作用前后原油流变性曲线 Fig. 2 Rheological curves of oil before and after microbial treatment |
将微生物作用前后的高凝原油收集起来,经脱水处理后,测定其凝固点:微生物作用前原油凝固点为52 ℃,微生物作用后原油凝固点为46 ℃,凝固点降低了6 ℃。
3.2 复合菌剂与地层本源菌的兼容性及其驱油能力为了验证复合菌与地层本源菌的兼容性及其驱油能力,将静35区块采出水与注入水以及活化的微生物菌液共同应用于物理模拟驱油实验。表 4为统计提高采收率情况及检测物模岩心驱出液中采油微生物浓度结果。
|
|
下载CSV 表 4 微生物驱油岩心模拟实验结果 Table 4 Results of microbial flooding physical simulation experiment |
实验结果表明,在低渗(50 mD)条件下采用微生物复合菌可使高凝油采收率提高6.46%,在中渗(200 mD)条件下采用微生物复合菌可以使高凝油采收率提高8.48%,检测出采油微生物在岩心驱出液中的浓度为(6~8)×106个/mL,考虑到微生物在岩心中缺乏营养条件而衰亡,这个浓度与注入浓度1×108个/mL差别不大,说明采油微生物生长不受注入水及采出液中微生物的影响,兼容性较好[24]。
3.3 吞吐现场试验效果初步评价为了进一步验证本次研究中微生物复合菌剂应用于高凝油微生物采油的有效性,于2013年6月对辽河油田沈阳采油厂静35区块5口油井即静35-30-134、静35-32-134、静35-32-136、静35-31-135、静35-31-134,实施微生物吞吐,共进行3个轮次,另外一口井静35-32-36于2013年11月底进行单轮次吞吐。
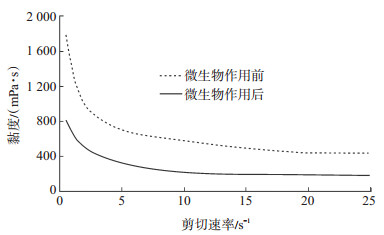
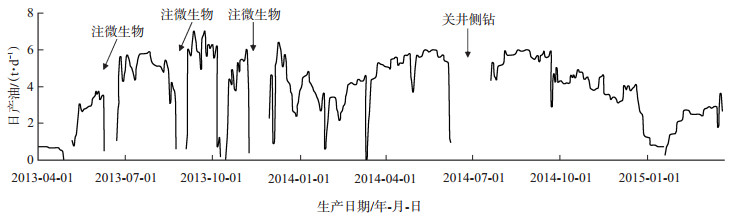
截至2014年6月6口井共累计增油1 344.4 t,其中见效明显的有5口井,分别是静35-30-134、静35-32-134、静35-32-136、静35-31-135及静35-32-36,见效率达83%。静35-32-36单井单轮次半年累积增油150多t,有效期达10个月(图 3);静35-32-136单井三轮次半年累积增油250多t,有效期达12个月(图 4)。
|
下载eps/tif图 图 3 油井35-32-36微生物吞吐采油 Fig. 3 Results of microbial huff and puff test in production well 35-32-36 |
|
下载eps/tif图 图 4 油井35-32-136微生物吞吐采油 Fig. 4 Results of microbial huff and puff test in production well 35-32-136 |
(1) 嗜热脂肪地芽孢杆菌菌株JD173、嗜热脱氮地芽孢杆菌菌株JD174和铜绿假单胞菌菌株JDC18对高凝油中四组分存在选择性降解,降解率为23.0%~42.3%,在降解性能上各菌株之间存在优势互补。
(2) 菌株JD173,JD174及JDC18均能将高凝油中长碳链饱和烃降解为短碳链烃类,高凝油经降解后w(nC21-)/w(nC22+)值和w(nC21+nC22)/w(nC28+nC29)值增大0.33~0.57。
(3) 铜绿假单胞菌菌株JDC18产生生物表面活性剂,使发酵液表面张力从72.21 mN/m降低至26.81 mN/m。嗜热脂肪地芽孢杆菌菌株JD173与嗜热脱氮地芽孢杆菌菌株JD174产生大分子生物乳化剂乳化高凝油,乳化指数分别达70.6%和82.3%。
(4) 由3类菌株构成的新型微生物复合菌剂可使高凝油黏度降低63.86%,凝固点降低6℃。物理模拟驱油实验结果表明,该复合菌剂在中渗(20 mD)及低渗(50 mD)条件下可以使高凝油采收率提高6.46%~8.48%。复合菌剂应用于辽河油田静35区块微生物吞吐矿场试验,成功率高达83%,单井最高累积增油250多t。
| [1] |
冯有良.
大民屯凹陷沙四段-沙三段层序地层格架及岩性油气藏预测. 岩性油气藏, 2008, 20(4): 14–19.
FENG Y L. 2008. Sequence stratigraphy framework and lithologic reservoirs prediction of the third and fourth members of Shahejie Formation, Damintun Depression. Lithologic Reservoirs, 2008, 20(4): 14-19. |
| [2] |
谢文彦, 李晓光, 陈振岩, 等.
辽河油区稠油及高凝油勘探开发技术综述. 石油学报, 2007, 28(4): 145–150.
XIE WY, LI X G, CHEN Z Y, et al. 2007. Review of exploration and development technologies for heavy oil and high pour-point oil in Liaohe oil region. Acta Petrolei Sinica, 2007, 28(4): 145-150. DOI:10.7623/syxb200704032 |
| [3] |
梁明亮, 王作栋, 郑建京, 等.
辽河断陷烃源岩有机地球化学特征. 岩性油气藏, 2014, 26(4): 110–116.
LIANG M L, WANG Z D, ZHENG J J, et al. 2014. Organic geochemical characteristics of hydrocarbon source rocks in Liaohe fault depression. Lithologic Reservoirs, 2014, 26(4): 110-116. |
| [4] |
孟庆学, 王玉臣.
高凝油及其开采技术. 石油科技论坛, 2006(5): 45–49.
MENG Q X, WANG Y C. 2006. High pour-point oil development technologies. Oil Forum, 2006(5): 45-49. |
| [5] |
程静波.
吉林油田高含蜡稠油油藏有效开发方式研究. 岩性油气藏, 2011, 23(4): 119–123.
CHEN J B. 2011. Study on effective development mode of high wax oil reservoir with high wax content in Jilin Oilfield. Lithologic Reservoirs, 2011, 23(4): 119-123. |
| [6] |
姚振杰, 马永晶, 金志, 等.
采出液回注方式对驱油效果的影响研究——以辽河油田J区块为例. 岩性油气藏, 2016, 28(3): 133–136.
YAO Z J, MA Y J, JIN Z J, et al. 2016. Influence of produced liquid reinjection way on oil displacement effect:a case study from J block in Liaohe Oilfield. Lithologic Reservoirs, 2016, 28(3): 133-136. |
| [7] |
于天忠, 张建国, 叶双江, 等.
辽河油田曙一区杜84块超稠油油藏水平井热采开发技术研究. 岩性油气藏, 2011, 23(6): 114–119.
YU T Z, ZHANG J G, YE S J, et al. 2011. Study on thermal exploitation technology of horizontal well in super heavy oil reservoir of Du 84 block in Liaohe Oilfield. Lithologic Reservoirs, 2011, 23(6): 114-119. |
| [8] |
FUJIWARA K, SUGAI Y, YAZAWA N, et al.
2004. Biotechnological approach for development of microbial enhanced oil recovery technique. Studies in Surface Science & Catalysis, 2004, 151(4): 405-445.
|
| [9] |
王惠, 卢渊, 伊向艺.
国内外微生物采油技术综述. 大庆石油地质与开发, 2003, 22(5): 49–52.
WANG H, LU Y, YI X Y. 2003. Review of domestic and international microbial enhanced oil recovery technology. Petroleum Geology & Oilfield Development in Daqing, 2003, 22(5): 49-52. |
| [10] |
王惠, 卢渊, 伊向艺, 等.
微生物采油技术的进展. 新疆石油地质, 2004, 25(3): 329–332.
WANG H, LU Y, YI X Y, et al. 2004. Review of domestic and international microbial enhanced oil recovery technology. Xinjiang Petroleum Geology, 2004, 25(3): 329-332. |
| [11] |
汪卫东.
微生物采油技术研究及试验. 石油钻采工艺, 2012, 34(1): 107–113.
WANG W D. 2012. Laboratory research and field trials of microbial oil recovery technique. Oil Drilling and Production Technology, 2012, 34(1): 107-113. |
| [12] |
宋春玲.
对于石油开采中微生物采油技术应用的探讨. 中国石油和化工标准与质量, 2011(8): 83.
SONG C L. 2011. Investigation on the application of microbial enhanced oil recovery in oil exploitation. China Petroleum and Chemical Standard and Quality, 2011(8): 83. |
| [13] |
汪卫东.
我国微生物采油技术现状及发展前景. 石油勘探与开发, 2002, 29(6): 87–90.
WANG W D. 2002. Current situation and development prospects of microbiological recovery technology in China. Petroleum Exploration and Development, 2002, 29(6): 87-90. |
| [14] |
张毅.
三次采油技术的研究现状与未来发展. 化学工程与装备, 2011(4): 119–120.
ZHANG Y. 2011. Research status and future development of the three oil extraction technology. Chemical Engineering & Equipment, 2011(4): 119-120. |
| [15] |
张林, 王彦, 梁岗.
微生物采油技术发展综述. 化学工程与装备, 2011(6): 159–160.
ZHANG L, WANG Y, LIANG G. 2011. Review of microbial enhanced oil recovery technology development. Chemical Engineering & Equipment, 2011(6): 159-160. |
| [16] |
ABBASI H, HAMEDI M M, LOTFABAD T B, et al.
2012. Biosurfactant -producing bacterium, pseudomonas aeruginosa MA01 isolated from spoiled apples:physicochemical and structural characteristics of isolated biosurfactant. Journal of Bioscience and Bioengineering, 2012, 113(2): 211-219.
DOI:10.1016/j.jbiosc.2011.10.002 |
| [17] |
JAIN R M, MODY K, MISHRAA, et al.
2012. Isolation and structural characterization of biosurfactant produced by an alkaliphilic bacterium Cronobacter sakazakii isolated from oil contaminated wastewater. Carbohydrate Polymers, 2012, 87(3): 2320-2326.
DOI:10.1016/j.carbpol.2011.10.065 |
| [18] |
KHOPADE A, BIAO R, LIU X, et al.
2012. Production and stability studies of the biosurfactant isolated from marine Nocardiopsis sp. B4. Desalination, 2012, 285: 198-204.
DOI:10.1016/j.desal.2011.10.002 |
| [19] |
ZHANG G L, WU YT, QIAN X P, et al.
2005. Biodegradation of crude oil by pseudomonas aeruginosa in the presence of rhamnolipids. Journal of Zhejiang University Science B, 2005, 6(8): 725-730.
|
| [20] |
刘清坤, 王君, 李国强, 等.
嗜热地芽孢杆菌DM-2烃降解特性研究. 环境科学, 2008, 29(12): 3554–3560.
LIU Q K, WANG J, LI G Q, et al. 2008. Characterization of a thermophilic Geobacillus strain DM-2 degrading hydrocarbons. Environmental Science, 2008, 29(12): 3554-3560. DOI:10.3321/j.issn:0250-3301.2008.12.043 |
| [21] |
LIU Y C, ZHOU T T, ZHANG J, et al.
2009. Molecular characterization of the alkB gene in the thermophilic Geobacillus sp. strain MH-1. Research in Microbiology, 2009, 160(8): 560-566.
DOI:10.1016/j.resmic.2009.08.010 |
| [22] |
MEINTANIS C, CHALKOU K I, KORMAS K A, et al.
2006. Biodegradation of crude oil by thermophilic bacteria isolated from a volcano island. Biodegradation, 2006, 17(2): 3-9.
DOI:10.1007/s10532-005-6495-6 |
| [23] |
SHREVE G S, INGUVA S, GUNNAM S.
1995. Rhamnolipid biosurfactant enhancement of hexadecane biodegradation by Pseudomonas aeruginosa. MolecularMarine Biology and Biotechnology, 1995, 4(4): 331-337.
|
| [24] |
SUTHAR H, HINGURAO K, DESAI A, et al.
2008. Evaluation of bioemulsifier mediated microbial enhanced oil recovery using sand pack column. Journal of Microbiological Methods, 2008, 75(2): 225-230.
DOI:10.1016/j.mimet.2008.06.007 |
 2017, Vol. 29
2017, Vol. 29